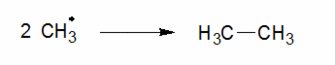Substitution radicalaire
| Cette page fait site WikiSbec de Sébastien Bruneau. Si vous êtes perdu, vous pouvez retourner à l'accueil en cliquant ici , ou au portail des sites sbeccompany.fr en cliquant ici |

|
Accueil | Chimie | Cours de chimie | Substitution radicalaire
La substitution radicalaire concerne les alcanes.
Ils réagissent avec les dihalogènes substitution radicalaire d’un H par un X.
Mécanisme
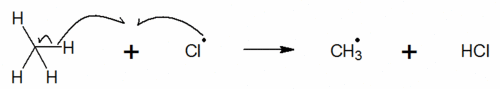
Etape d’initiation
On génère des radicaux libres qui vont réagir avec l’alcane pour former d’autres radicaux.
Remarque : on peut aussi former des radicaux libres avec des peroxydes RO-OR’.
Etape de propagation
Ce radical va réagir avec l’alcane pour former un radical carboné.
Ce Cl- va réagir avec un autre CH4. On a une réaction qui s’auto entretien.
Etape de terminaison
Il y a 3 possibilités en fonction de ce qu’il reste dans le milieu :
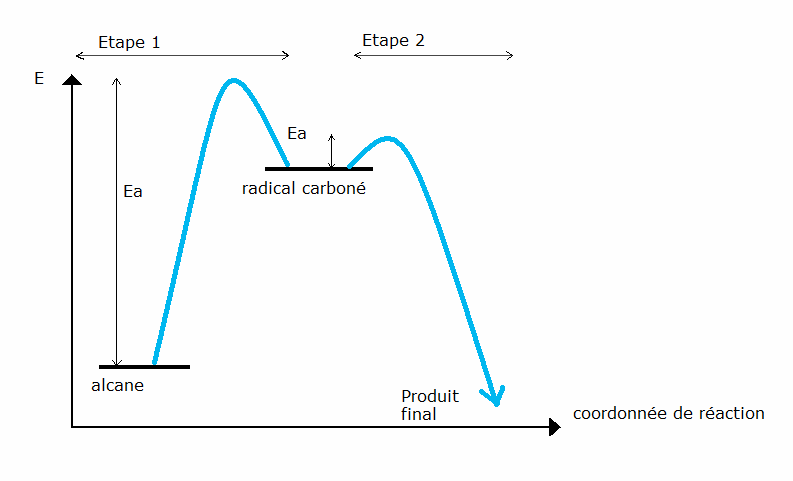
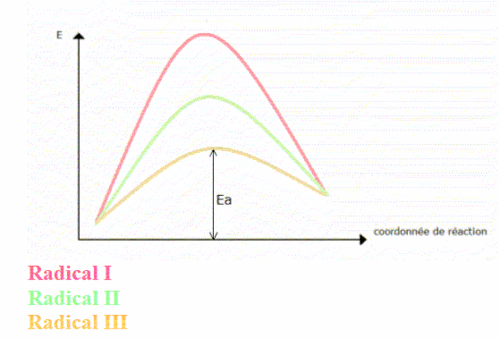
Diagramme énergétique
Il représente les variations d’énergie qui ont lieu au cours de la réaction.
L’énergie d’activation (Ea) détermine la vitesse de réaction. En effet, v = k[c] avec k = Aexp(-Ea/RT). Plus Ea est grande, plus la vitesse est faible. La deuxième étape est plus rapide que la première.
Régiosélectivité
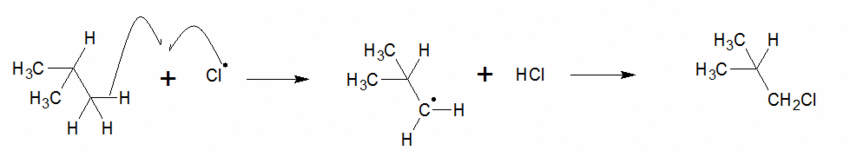
C’est l’endroit où va se faire la réaction. Dans une molécule, tous les H différents conduisent à des produits différents.
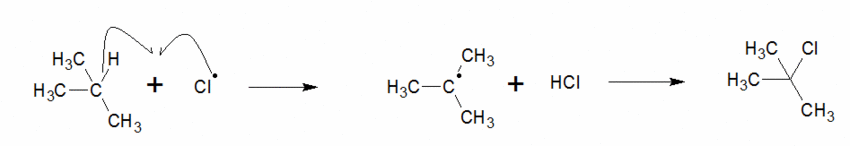
Exemple : le 2-méthylpropane.
On a deux types de H dans cette molécule.
On a une chance sur dix d’obtenir ce produit.
On a neuf chances sur dix d’obtenir celui-ci.
Statistiquement le deuxième devrait être majoritaire or il se trouve qu’en réalité c’est le premier (car le carbocation intermédiaire est plus stabilisé grâce aux effets inducteurs).
Si un radical est plus stable qu’un autre, alors l’énergie d’activation qui conduit au plus stable est plus faible que celle qui mène au second.
On forme beaucoup plus vite le radical stable. C’est la vitesse de réaction qui influe sur la régiosélectivité.
Lorsque plusieurs produits peuvent être obtenus, le composé majoritaire sera celui qui résulte de la formation du radical le plus stable.
Remarque : un radical tertiaire est plus stable qu’un secondaire qui est plus stable qu’un primaire.
Comme tous les H sont susceptibles d’être substitués, on obtient des mélanges de produits que l’on sépare par distillation.
| Portail de la chimie – Accédez aux articles du Wikisbec concernant la chimie. |