Électrolyse de l'eau
Aller à la navigation
Aller à la recherche
Accueil | Chimie | Sbec Labs | Expériences amusantes | Electrolyse de l'eau
Cette expérience permet de dissocier l'eau en dioxygène et dihydrogène par électrolyse. Deux tests pourront êtres effectués pour montrer la présence de ces deux gaz.
| Difficulté | Recherche des réactifs |
Fabrication de l'électrolyseur | Dangerosité | Durée |
| Facile | Très facile | Difficile | Moyen | 30min |
Matériel
- 1 électrolyseur
- de l'eau distillée ou déminéralisée (quantité suffisante pour remplir votre électrolyseur)
- quelques grains d'hydroxyde de sodium (facultatif mais très fortement conseillé)
- des tubes à essais ou un équivalent comme des petites boites de tic-tac par exemple
- un système de pinces pour fixer les tubes à essais ou de la patience et une main à défaut
Précautions
- Ne pas tenter de récupérer de grandes quantité de gaz durant l'expérience pour faire les tests dessus. Un tube à essai suffit et n'est pas dangereux.
- Ne jamais mélanger les deux gaz !!!
- Attention à ne pas créer de court-circuit entre de l'eau qui et les fils électriques.
Manipulation
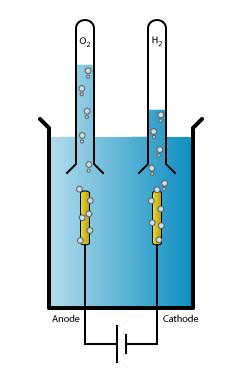
- Remplir la cuve à électrolyse avec l'eau. Le niveau de l'eau doit être au dessus des électrodes.
- Tapisser le fond de la cuve de quelques grains de soude.
- Fixer un tube à essai retourné (ou équivalent) et rempli d'eau sur chaque électrode. A défaut, les tenir à la main.
- Brancher la pile ou le générateur.
- Des bulles se dégagent des deux électrodes et remplissent les tubes.
- Une fois les tubes à essai asssez remplis (après beaucoup de temps s'il n'y avait pas de soude), les récupérer en les bouchant avec le pouce pour que le gaz ne s'échappe pas.
- Tests caractéristiques des gaz :
- Pour le tube à la cathode (borne - de la pile), placer une allumette enflammée à l'ouverture du tube en retirant rapidement le pousse. Une petit explosion a lieu (bruit d'un aboiement appelé "jappement"). Voir explications.
- Pour le tube à l'anode (borne + de la pile), placer une allumette incandescente à l'ouverture du tube en retirant rapidement le pousse. L'alumette se ravive. Voir explications.
Explications
- Une réaction d'oxydoréduction (dismutation) a lieu dans l'électrolyseur :
- A l'anode : oxydation de l'eau <math>2H_2O_{(l)} \rightarrow O_2_{(g)} + 4H^+_{(aq)} + 4e^-</math>
- A la cathode : réduction de l'eau <math>4H_2O_{(l)} + 4e^- \rightarrow 2H_2_{(g)} + 4HO^-_{(aq)}</math>
- Bilan : <math>2H_2O_{(l)} \rightarrow 2H_2_{(g)} + O_2_{(g)}</math>
- A l'anode, on a donc produit de dioxygène O2. Le dioxygène est un gaz comburant, c'est-à-dire qu'il favorise la combustion des matériaux. Lorsque l'on met en présence du dioxygène et une allumette tout juste éteinte, l'allumette se remet à brûler.
- A la cathode, on a donc produit du dihydrogène H2. Le dioxygène est un gaz explosif. La flamme de l'allumette engendre la détonation (explosion du dihydrogène).
| Portail de la chimie – Accédez aux articles du Wikisbec concernant la chimie. |